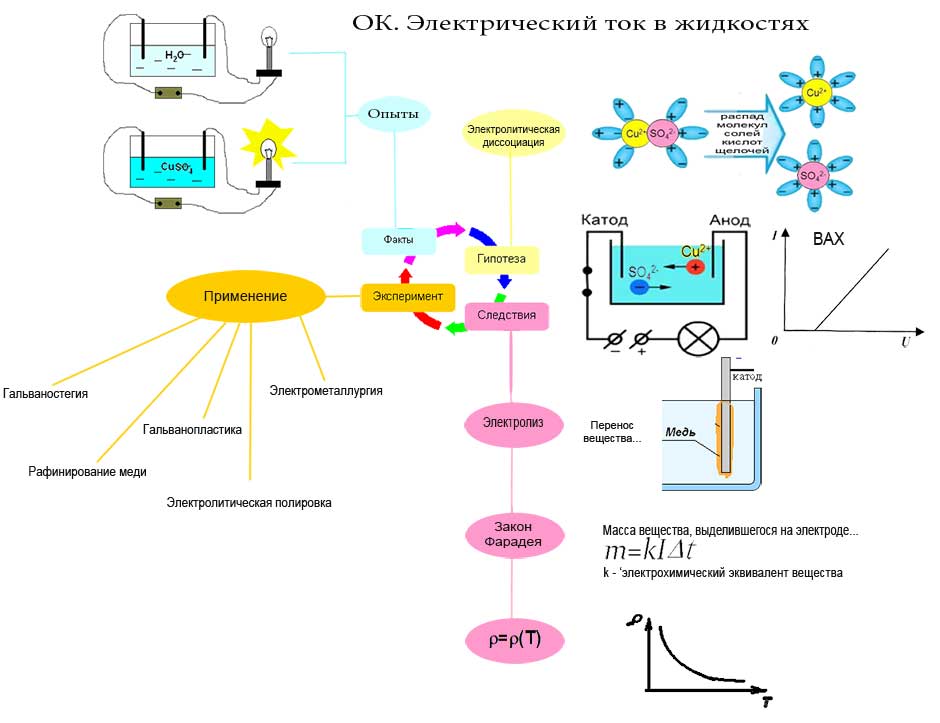
Знакомство с явлением
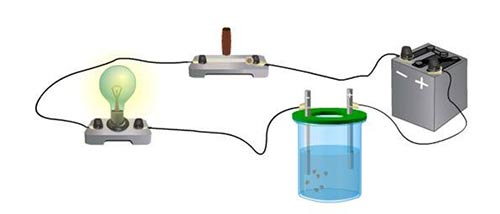
Соединим с источником тока последовательно лампу и электролитическую ванну с дистиллированной водой, в которую опущены угольные электроды. Химически чистая вода почти не проводит ток.
Если же в воде растворить соль (например CuSO4, CuCl2), то лампочка загорится, а на катоде из раствора выделится медь.
Электролитическая диссоциация
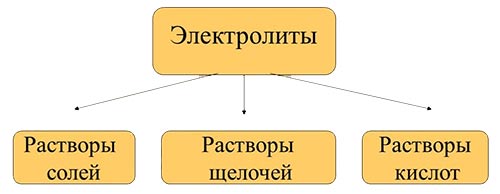
По способности проводить электрический ток в водном растворе и расплаве все вещества делятся на электролиты и неэлектролиты.
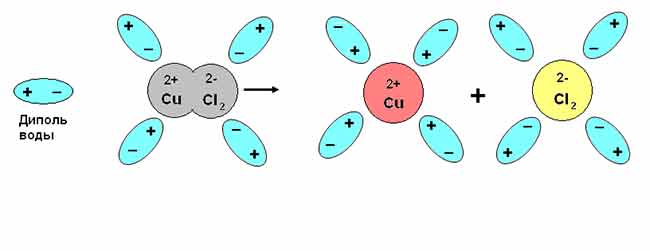
Электролитическая диссоциация — явление расщепления нейтральных молекул кислот, солей и щелочей при их растворении на положительные и отрицательные ионы.
Интенсивность электролитической диссоциации зависит:
- От температуры раствора.
- От концентрации раствора.
- От рода раствора (его диэлектрической проницаемости).
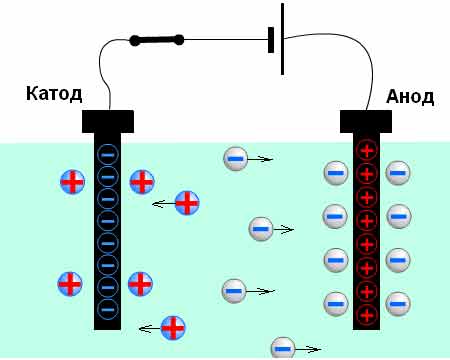
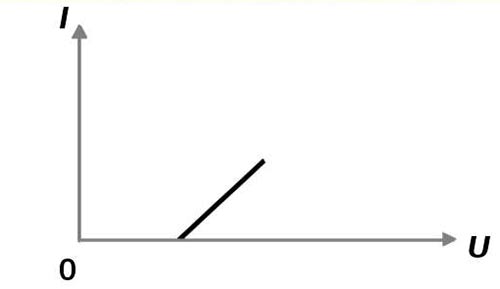
Электрический ток в растворах и (или расплавах) электролитов представляет собой упорядоченное перемещение ионов обоих знаков в противоположных направлениях.
На вольт-амперной характеристике график смещен вследствие явления поляризации.
Справедлив закон Ома при неизменной концентрации раствора и температуры.
Электролиз
Электролиз — перенос вещества при прохождении электрического тока через электролит.
Закон электролиза Фарадея
Масса вещества, выделившегося на электроде за время Dt при прохождении электрического тока, пропорциональна силе тока и времени:
k — электрохимический эквивалент вещества (![]() ).
).
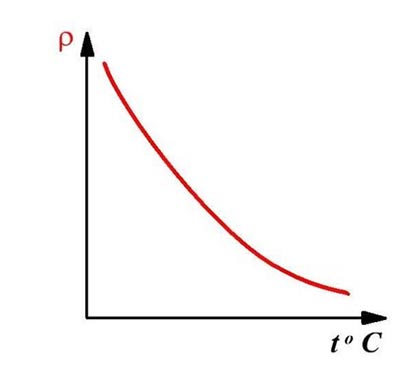
Сопротивление электролита уменьшается с ростом температуры, т. к. увеличивается количество ионов вследствие электролитической диссоциации.
Закон Фарадея позволяет определить заряд электрона:
Вывод о существовании в природе элементарного электрического заряда был сделан Гельмгольцем в 1881 г.
Применение электролиза
Рафинирование (очистка) металлов
Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например при рафинировании меди — раствор медного купороса.
При определенных условиях на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия
Некоторые металлы, например алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным подом, а анодом — угольные стержни. Температура руды (около 9000 С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через отверстие выпускают в форму для отливки.
Гальваностегия
Электролитический способ покрытия металлических изделий слоем благородных металлов не поддающихся окислению.
Гальванопластика
Используется для воспроизведения формы рельефных предметов (медалей, монет, точных копий художественных изделий).
Электроэпиляция
Используется в косметологии для удаления волос воздействием на волосяные фолликулы очень тонкими иголками.
Опорный конспект:


























![]:-> ]:->](https://fizclass.ru/wp-content/themes/ab-inspiration/inc/qipsmiles/smiles/devil.gif)























