Термодинамика — это теория тепловых явлений, происходящих в макротелах и их системах без учета атомно-молекулярного строения тела.
Термодинамика изучает свойства термодинамической системы в состоянии термодинамического равновесия и процессы перехода этих систем из одного состояния в другое.
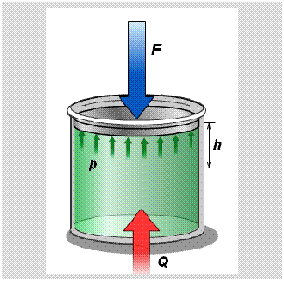
В теплоизолированном цилиндре под невесомым поршнем находится идеальный газ. Сообщим системе некоторое количество теплоты Q и воздействуем на поршень некоторой внешней силой F. Рассмотрим, как изменяются параметры системы
Состояние термодинамической системы характеризуется рядом физических величин, главной из которых является внутренняя энергия.
Существует два способа изменения внутренней энергии тела:
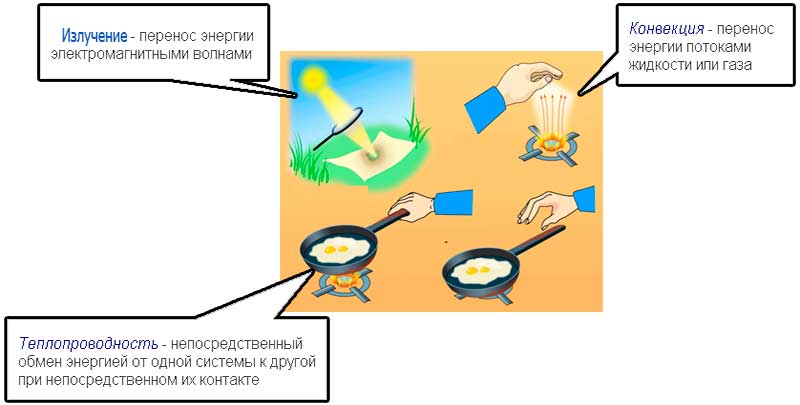
1. Теплопередача — это процесс передачи энергии от одного тела к другому без совершения работы. Виды теплопередачи:
Количество теплоты, переданное при нагревании тела или выделяемое при его охлаждении:
Q=cmΔT
c — удельная теплоемкость вещества
Количество теплоты, идущее на плавление тела или выделяемое при его кристаллизации:
Q=λm
λ — удельная теплота плавления и кристаллизации тела
Количество теплоты, идущее на испарение жидкости при T=const или выделяемое при конденсации пара:
Q=Lm
L — удельная теплота парообразования и конденсации
2. Совершение механической работы
Изменение внутренней энергии тела (системы тел) определяется первым законом (началом) термодинамики
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
![]() Если система сама совершает работу над внешними силами, то А=-А‘ и первый закон термодинамики запишется так:
Если система сама совершает работу над внешними силами, то А=-А‘ и первый закон термодинамики запишется так:
Изопроцессы в термодинамике
Простейшими процессами перехода термодинамической системы из одного состояния в другое являются:
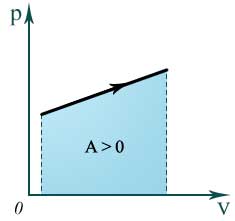
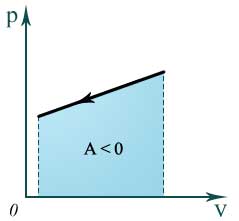
Изобарный процесс p=const
Q=ΔU+A’
Изохорный процесс V=const
Q=ΔU
Газ не меняет своего объема, работа им не совершается. Т.о переданное количество теплоты идет на увеличение внутренней энергии газа.
Изотермический процесс T=const
Q=A’
Внутренняя энергия не меняется. Следовательно количество теплоты, переданное системе идет на совершение работы
Адиабатный процесс Q=0
A=ΔU
Процесс происходящий в системе без теплообмена с окружающей средой. При совершении работы над газом внутренняя энергия системы увеличивается, следовательно увеличивается и температура газа.
Опорный конспект:
Краткие итоги:
Термодинамика – это теория тепловых явлений, происходящих в макротелах и их системах без учета атомно-молекулярного строения тел.
Термодинамика изучает свойства термодинамической системы в состоянии термодинамического равновесия и процессы перехода этих систем из одного состояния в другое.
Состояние термодинамической системы характеризуется рядом физических величин, главной из которых является внутренняя энергия. Внутреннюю энергию можно изменить в процессе теплопередачи и совершения работы. Существование двух форм изменения внутренней энергии – работы и теплообмена, отражает первый закон термодинамики, который является законом сохранения и превращения энергии применительно к тепловым процессам. Открытие этого закона в середине XIX в. связано с работами Р.Майера, Д.Джоуля и Г.Гельмгольца.
Простейшими процессами перехода термодинамической системы из одного состояния в другое является изотермический, изобарный, изохорный и адиабатный.
Термодинамика позволяет объяснить работу тепловых машин, выполнить расчеты тепловых процессов.
Задачи на применение первого закона термодинамики
1А. При изотермическом расширении идеальным газом совершена работа А = 20 кДж. Какое количество теплоты сообщено газу?
2А. Вычислите увеличение внутренней энергии кислорода массой 0,5 кг при изохорном повышении его температуры на 15 °С.
3В. Температура газа в цилиндре 150 °С, а давление 8 ∙ 105 Па. Газ изохорно охлаждается. Конечное давление 2 ∙ 105 Па. Найдите изменение внутренней энергии газа массой 1 кг, его конечную температуру и совершенную работу. Удельная теплоемкость газа при постоянном объеме равна 0,7 ∙ 103 Дж/(кг ∙ К).
4В. В вертикальном цилиндре под тяжелым поршнем находится кислород массой 2 кг. Для повышения температуры кислорода на 5 К ему было сообщено количество теплоты, равное 9160 Дж. Найдите работу, совершаемую при расширении кислорода, и увеличение его внутренней энергии. Молярная масса кислорода 0,032 кг/моль.
5В. В сосуде с теплонепроницаемыми стенками объемом 5,6 л находится кислород при температуре 66 °С и давлении 0,25 МПа. Для нагревания газа до температуры 68 °С требуется сообщить газу теплоту 21 Дж. Какова удельная теплоемкость кислорода при этих условиях?
6В. В теплоизолированном цилиндре с поршнем находится азот массой 0,2 кг при температуре 20 °С. Азот, расширяясь, совершает работу 4470 Дж. Определите изменение внутренней энергии азота и его температуру после расширения. Удельная теплоемкость азота при постоянном объеме 745 Дж/ (кг ∙ К).
7В. Какое количество теплоты требуется для того, чтобы воздух массой 5 г нагреть от температуры 290 К при постоянном давлении на столько, чтобы его объем увеличился в два раза? Удельная теплоемкость воздуха при постоянном давлении 1018 Дж/(кг ∙ К).
8С. Кислород, взятый в количестве 1 моль, нагревается при постоянном объеме от температуры 0 °С. Какое количество теплоты требуется сообщить кислороду, чтобы его давление увеличилось в 3 раза? Удельная теплоемкость кислорода при постоянном объеме 657 Дж/(кг ∙ К).
9С. Для повышения температуры газа массой 20 кг и молярной массой 0,028 кг/моль на 50 К при постоянном давлении необходимо затратить количество теплоты, равное 0,5 МДж. Какое количество теплоты следует отнять от этого газа при постоянном объеме, чтобы его температура понизилась на 50 К?
10С. Давление азота, находящегося в сосуде объемом 3 л, после нагревания возросло на 2,2 МПа. Определите количество теплоты, сообщенной газу. Удельная теплоемкость азота при постоянном объеме 745 Дж/(кг ∙ К), его молярная масса 0,028 кг/моль.
Ответы
1А. 20 кДж.
2А. 6900 Дж.
3В. ≈ — 220 кДж/кг; ≈ 106 К; 0 Дж.
4В. 2590 Дж; 6570 Дж.
5В. ≈ 660 Дж/ (кг ∙ К).
6В. 4470 Дж; — 10 °С.
7В. 1,49 ∙ 103 Дж.
8С. 1,15 ∙ 107 Дж.
9С. 2 ∙ 105 Дж.
10С. 1,65 ∙ 104 Дж.